1、海思科投入近2亿,提交NDA,纳入优先审评
2019年8月21日,CDE海思科新药HSK3486乳状注射液(规格:20ml:50mg)的上市申请纳入优先审评程序。
HSK3486乳状注射液是在经典老药丙泊酚基础上改良创新的新药。拟用于手术全麻诱导、内镜诊疗的镇静/麻醉、ICU镇静等适应症。

HSK3486 于2016 年 1 月获得国家药品监督管理局下发的《药 物临床试验批件》,启动“消化道内镜诊断和治疗镇静和/或麻醉” 适应症的临床试验,现已完成Ⅲ期临床试验及数据清理等工作,新药申请(特殊审批程序)于 2019 年 07 月 29 日获得国家药品监督管理局受理。中国成人手术麻醉诱导适应症的Ⅲ期临床试验正在进行中。
基于未来开拓 HSK3486 国际市场的考虑,公司拟在美国开展临床试验,目前公司已向美国 FDA 递交了 Pre-IND 会议申请并获得邮件确认,预计近期将召开会议。
截至2019年7月31日,海思科在 HSK3486 乳状注射液的研发投入约 1.91 亿元。
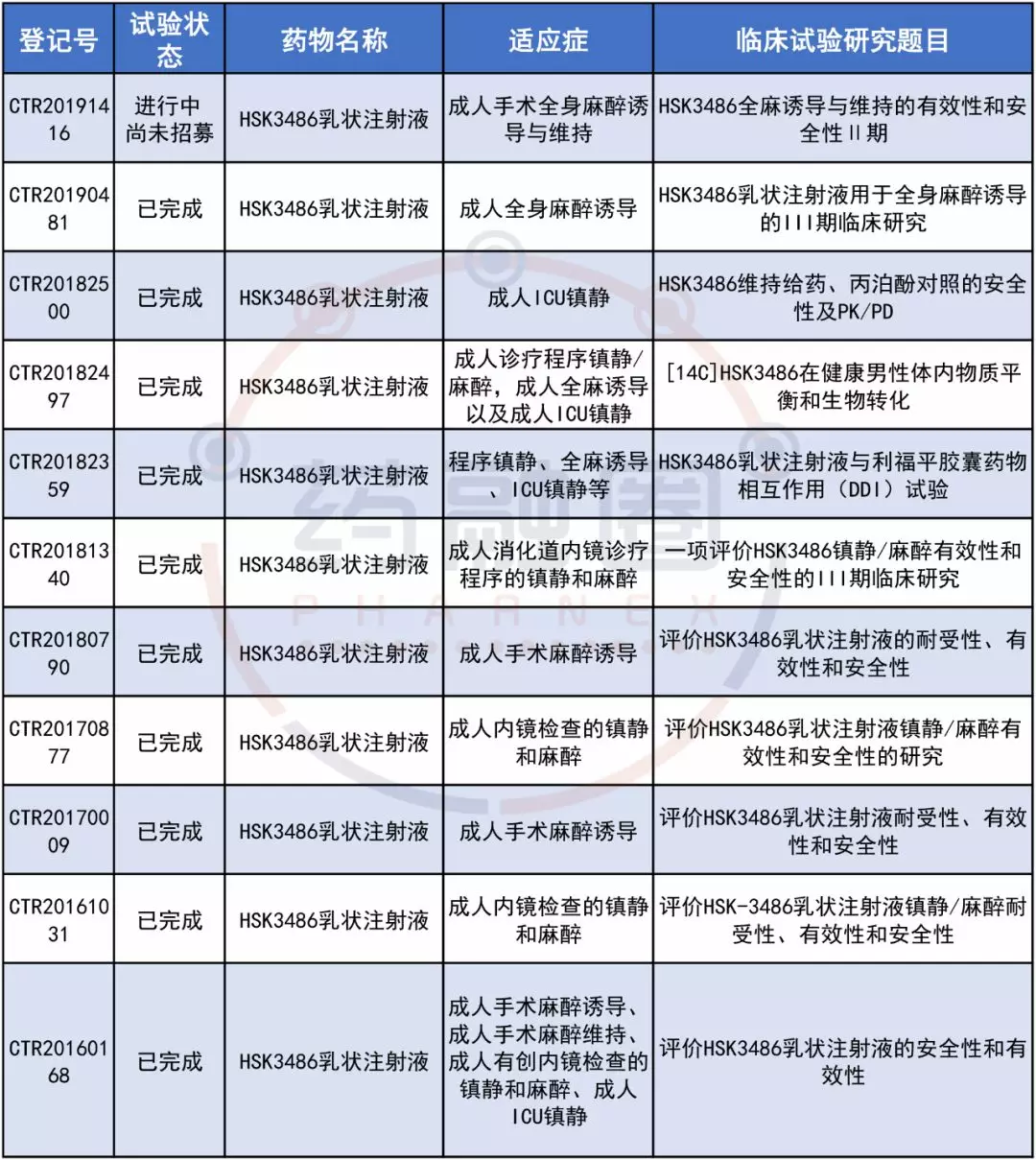
2、海思科本款麻醉镇静新药目前登记的临床试验
3、拿被改良的老药丙泊酚来讲
据米内网数据,丙泊酚乳状注射液在中国公立医疗机构终端销售额2018年销售额35.7亿元,同比增长0.9%。丙泊酚目前是国内市场第一大全麻品种,在2018年中国公立医疗机构终端麻醉剂TOP20品种中以25.22%的市场份额位居首位。
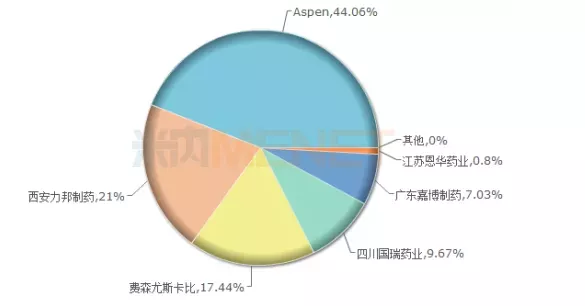
(来源:米内网中国公立医疗机构终端,丙泊酚乳状注射液竞争格局)
Aspen本款资产转手由AZ管理。
4、在麻醉镇静领域,另外还有两款国产/合作新药在NDA审评中
分别是恒瑞医药的注射用甲苯磺酸瑞马唑仑以及宜昌人福的注射用苯磺酸瑞马唑仑。
(1)注射用甲苯磺酸瑞马唑仑是一种短效的GABAa受体激动剂,适用于择期手术中的全身麻醉,具有起效和失效迅速、镇静作用稳定、恢复时间短等特点。2018年3月胃镜适应症申报生产并被CDE纳入优先审评。2019年8月,注射用甲苯磺酸瑞马唑仑肠镜适应症因具有明显治疗优势,被CDE纳入拟优先审评品种公示名单。
(2)宜昌人福药业注射用苯磺酸瑞马唑仑结肠镜Ⅲ期临床试验已完成,并已于2018年11月申报生产,因为其具有明显独特的临床治疗优势,2019年1月被CDE纳入优先审评品种公示名单。注射用苯磺酸瑞马唑仑是由宜昌人福药业和德国Paion公司合作开发的一种超短效GABAa受体激动剂。
相关阅读
1、严惩涨价和放开审批双管齐下 原料药垄断问题能否真正解决?
关键词:海思科 新药 审评
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1