在药用植物来源的天然产物中,秋水仙碱堪称横跨医学、药物学、细胞生物学教科书的“三栖明星”。秋水仙碱在多个国家和地区都被用为治疗痛风急性发作的一线药物,并建议在痛风急性发作24-48小时内尽早使用,还能用于治疗家族性地中海热、心包炎和 Behcet 病。还有研究表明,秋水仙碱也有潜力用于肿瘤治疗,它的作用机制与紫杉烷、长春花碱等抗肿瘤药物类似,可以与细胞中微管蛋白二聚体相互作用并抑制微管形成,使细胞停止于有丝分裂中期,从而导致癌细胞死亡。不过,秋水仙碱因对非靶细胞的毒性太大而尚未获批成为临床一线抗肿瘤化疗药物,但其结合微管蛋白并抑制有丝分裂的能力使其成为重要的细胞生物学研究工具。事实上,秋水仙碱常常被用于鉴定人类染色体数目,研究微管动力学并诱导植物多倍体。(重要提示:秋水仙碱治疗痛风的有效剂量和中毒剂量非常接近,切勿自行购买服用,务必遵医嘱!)
用途广泛就意味着需求量大。为制备秋水仙碱,化学合成法取得了不少进展,比如李闯创教授课题组2017年报道了一种新策略,9步完成秋水仙碱不对称全合成,规模可达到克级(Chem. Sci., 2017, 8, 4961-4966)。然而,迄今为止工业上制备秋水仙碱仍然主要依靠植物分离提取,效率不高。利用生物合成法来制备秋水仙碱是一项既有工业应用前景又极具开创性和挑战性的研究。近日,美国斯坦福大学的Elizabeth S. Sattely教授团队在Nature上发表论文,结合转录组学、代谢途径重构阐明了近乎完整的秋水仙碱生物合成途径。他们从嘉兰(Gloriosa superba)中发现了生物合成N-甲酰秋水仙胺(秋水仙碱的前体)的八种基因,还确定了一种催化产生秋水仙碱独特碳骨架所需的扩环反应的非经典细胞色素P450。他们进一步使用新发现的基因在本氏烟(Nicotiana benthamiana)中重构了生物合成途径(总共包含16种酶),从氨基酸(苯丙氨酸和酪氨酸)出发合成N-甲酰秋水仙胺。这为工业上秋水仙碱类生物碱的生物合成打下了坚实的基础。

图1. Elizabeth S. Sattely 博士(右一)团队。图片来源:Sattely Group [1]
由于目前生物合成研究主要集中在微生物领域,而有关秋水仙碱类生物碱的研究甚少。在开展这项工作的时候,作者只能基于以往两项研究获取信息:(1)在秋水仙科植物中开展的多种同位素标记饲喂实验;(2)从秋水仙科植物中分离纯化的秋水仙碱相关生物碱的结构表征。他们从中总结出一个较为明确的生物合成假说:秋水仙碱结构中的核心部分起源于L-苯丙氨酸和L-酪氨酸,二者分别可以合成4-羟基二氢肉桂醛(4-HDCA)和多巴胺,而4-HDCA和多巴胺又可以通过Pictet-Spengler反应连接在一起生成1-苯基异喹啉骨架(1)。化合物1通过一系列甲基化、羟基化反应生成(S)-autumnaline(7)。后者通过para–para苯酚偶联和甲基化作用生成O-Methylandrocymbine(9),最后通过C环扩张和N-乙酰基化形成秋水仙碱(图2)。
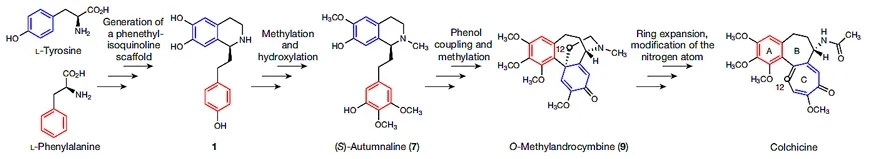
图2. 推测的秋水仙碱生物合成。图片来源:Nature
在此基础上,他们先从代谢组学和转录组学分析着手。在代谢组学研究过程中,他们观察到秋水仙碱在根茎、茎、根和叶组织中的积累存在着显著的差异,根茎中积累的秋水仙碱和相关代谢物水平最高(图3)。为了鉴定出秋水仙碱合成途径中催化1-苯乙基喹啉前体(1)反应的初始甲基转移酶,结合先前的研究结果,他们在嘉兰转录组中鉴定出11个甲基转移酶候选基因。每种甲基转移酶均克隆自嘉兰cDNA,在本氏烟叶片中进行表达,烟叶的蛋白裂解产物在体外用化合物1来检测甲基转移酶活性。结果显示,其中的一个O-甲基转移酶基因(GsOMT1)能催化1生成化合物2。随后,他们用表达GsOMT1的本氏烟叶片来直接进行体内活性检测,渗透化合物1后同样从烟叶提取物中检测到化合物2(图4)。于是,他们乘胜追击,继续使用该方法,并结合GsOMT1 重新测试了剩余的10个甲基转移酶候选基因。发现一个N-甲基转移酶(GsNMT)可以催化2生成N-甲基化产物3(图4)。他们注意到GsOMT1和GsNMT 在嘉兰公开的转录组中高度相关(Pearson’s r > 0.99),这表明共表达分析有助于筛选出其它候选酶基因。在11个甲基转移酶基因中,只有5个(包括GsNMT)与GsOMT1 表现出相对较高的共表达(Pearson’s r > 0.5),这表明这些甲基转移酶也可以在秋水仙碱的生物合成中起作用。随后,他们发现7个独特的细胞色素P450基因也能与GsOMT1 共表达(Pearson’s r > 0.9)。

图3. 通过表达相关性分析在嘉兰转录组中鉴定候选甲基转移酶和细胞色素P450转录本图片来源:Nature
研究发现,细胞色素P450(GsCYP75A109)能部分消耗3,在A环间位发生单羟基化产生化合物4。为提高4的产量,他们优化了GsNMT,发现截短N端特定序列能将4的产量提高近10倍。于是,将截短后的酶(GsNMTt)用于后续所有的实验中。随后作者发现在系统中共表达甲基转移酶(GsOMT2)会导致4的消耗,产生化合物6,却没有检测到化合物5。他们推测化合物5一经产生可能就被GsCYP75A109迅速消耗掉了。接着添加甲基转移酶(GsOMT3)导致6的消耗和(S)-Autumnaline(7)的产生。有趣的是,(S)-Autumnaline(7)是第一个既可从生物重组合成中获得,又可从秋水仙科植物中分离的生物碱。这表明在本氏烟中重构了秋水仙碱的生物合成路径。随后,在系统中共表达P450酶(GsCYP75A110)导致了7的消耗,同时产生了3个化合物,其中一个是Isoandrocymbine(8),另一个化合物在甲基转移酶(GsOMT4)的催化下产生O-Methylandrocymbine(9)。值得一提的是,化合物8和9都是秋水仙碱的前体(图4)。
然而,他们在嘉兰的转录组中没有发现能够催化9形成秋水仙碱卓酚酮(环C)的P450酶候选基因,有意思的是,在黄连(C. autumnale)数据中找到了一个之前被忽略的P450酶 (CYP71FB1),它与前面鉴定的其他基因有相对较高的共表达(Pearson’s r > 0.8)。果然,GsCYP71FB1在烟叶表达系统中能催化9生成扩环产物N-甲酰秋水仙胺(10)。至此,他们从嘉兰中鉴定出8种酶,在本氏烟中重构了一条从苯乙基异喹啉底物(1)到N-甲酰秋水仙胺(10)的生物合成路线,证实了拟议的生物合成途径,该途径是由多年同位素标记研究和秋水仙科植物代谢物的分离纯化而建立的,进一步展示了植物如何合成含卓酚酮骨架的秋水仙碱(图4)。
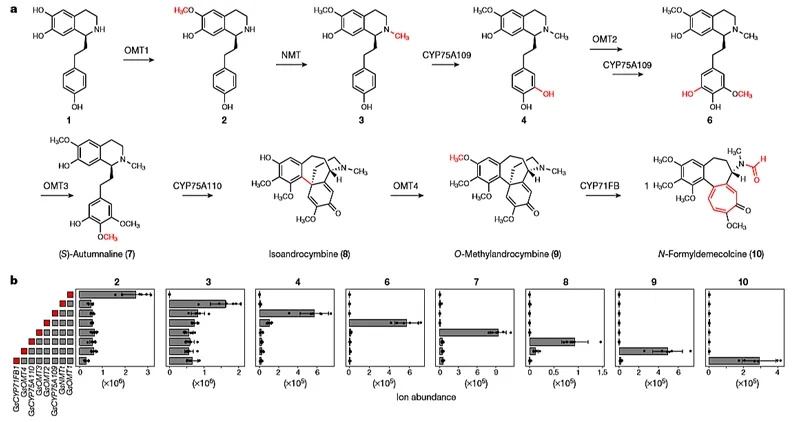
图4. 秋水仙碱生物合成路径的发现。图片来源:Nature
最后,为满足秋水仙碱合成前体的需求,作者在本氏烟中开发出一个产生化合物1的代谢工程策略。他们以本氏烟为表达载体,分别构建了两个基因表达模块,模块1包含酶基因GsPAL、Gs4CL、GsCCR、GsAER、GsC4H和GsDAHPS,用于催化苯丙氨酸合成为4-HDCA;模块2包含酶基因BvCYP76AD5和GsTyDC/DDC,用于催化酪氨酸合成多巴胺。由于4-HDCA和多巴胺需通过Pictet-Spengler缩合反应形成1,于是他们尝试用已鉴定的(S)-去甲樟碱合酶(NCS)来催化此反应。研究发现,来自黄连的截短NCS基因(Δ24 CjNCS)和模块1、模块2异源共表达能够产生化合物1。随后,他们将下游生物合成基因(GsOMT1、GsNMTt、GsCYP75A109、GsOMT2、GsOMT3、GsCYP75A110、GsOMT4和GsCYP71FB1)组成模块3加入此共表达系统中,产生了N-甲酰秋水仙胺(10)。这些数据也进一步表明了1-7的中间产物是S型对映异构体(图5)。
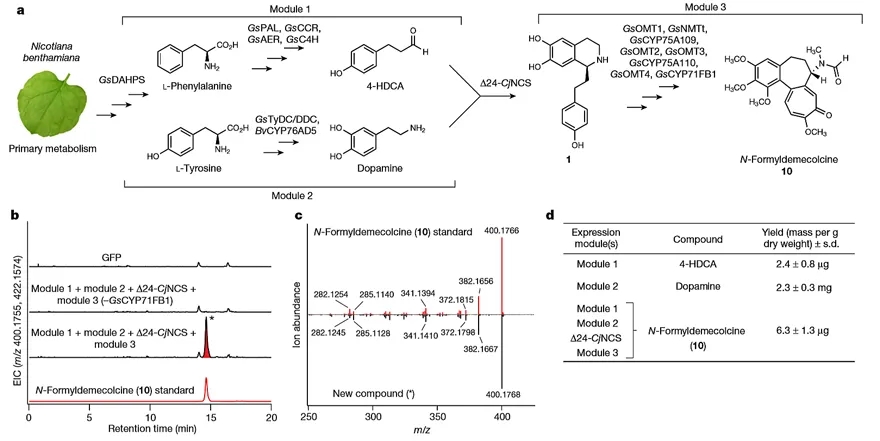
图 5. 以本氏烟为载体从初级代谢产物中合成N-甲酰秋水仙胺(10)。图片来源:Nature
总结
从秋水仙科植物的代谢物同位素标记研究,到嘉兰中秋水仙碱的分离纯化鉴定,再到本氏烟中近乎完整的异源生物合成途径重构,秋水仙碱,这一同时具备历史和当代意义的植物来源天然产物,在Elizabeth S. Sattely 教授课题组的研究中实现了华丽的跨越。他们的研究不仅展示了合成秋水仙碱典型卓酚酮骨架的代谢途径,也为加速发现和开发药用植物天然产物的生物合成开创了一条新的道路。
关键词:秋水仙碱 生物合成
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1