今日(11月19日),国家药监局发布两则公告,分别修订脑苷肌肽注射液、复方骨肽注射剂的药品说明书。


公告要求,所有脑苷肌肽注射液、复方骨肽注射剂的生产企业均应依据《药品注册管理办法》等有关规定,按照相对应的说明书修订要求,提出修订说明书的补充申请,于2020年1月8日前报省级药品监管部门备案。 修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后6个月内对所有已出厂的药品说明书及标签予以更换。
▍一药品,增加警示语
根据国家药监局要求,脑苷肌肽注射液的药品说明书要增加【警示语】,内容如下:
本品含有单唾液酸四己糖神经节苷脂。国内外药品上市后监测中发现可能与使用神经节苷脂产品相关的急性炎症性脱髓鞘性多发性神经病(又称吉兰-巴雷综合征)病例。若患者在用药期间(一般在用药后5—10天内)出现持物不能、四肢无力、弛缓性瘫痪等症状,应立即就诊。吉兰-巴雷综合征患者禁用本品。
早在2016年11月,原国家食药监总局发文曾修订单唾液酸四己糖神经节苷脂注射剂的药品说明书增加警示语和进行修订,而脑苷肌肽注射液作为复方制剂,当时并不在修订说明书范围内。
查询资料发现,吉兰-巴雷综合征(GBS)是以周围神经和神经根的脱髓鞘病变及小血管炎性细胞浸润为病理特点的自身免疫性周围神经病,经典型的GBS称为急性炎症性脱髓鞘性多发性神经病(AIDP),临床表现为急性对称性弛缓性肢体瘫痪。
▍一药品,儿童禁用
根据国家药监局要求,复方骨肽注射剂要在在原有说明书基础上增加【警示语】:
本品有严重过敏反应病例报告,对本品过敏者禁用。本品应在有抢救条件的医疗机构使用,使用者应接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治。
同时,在原有【禁忌】的基础上,添加如下内容:
儿童禁用。
孕妇及哺乳期妇女禁用。
严重肝肾功能不全者禁用。
此前,有不少药品在被修改说明书时,都有特别提到儿童禁用或者慎用。可见,现在各方对于儿童用药安全也越来越重视。
相信大家已经发现,上述被修订说明书的两个药品,都是国家首批国家重点监控合理用药目录的品种。
深圳市第二人民医院药学部主任吴建龙对赛柏蓝表示,国家相关管理部门针对收集到的信息和不良反应监测数据,对这两个品种修订说明书是一种非常负责的态度,说明这些药以前的说明书没有提供足够的信息供医师、药师和患者用前参考与评估获益风险。他还提醒,公众需使用这类药品可以在用前咨询医师和药师获益与风险,注意防范相关风险,发生疑似不良反应应及时就医。
▍均为重点监控大品种
除了重点监控目录的出台,在今年医保目录调整中,重点监控药品还被全部调出国家医保目录。而在随后的地方医保目录清理工作中,也有消息称重点监控目录药品率先移出医保目录。
据米内网数据显示,脑苷肌肽2018年的市场销售额约33亿,市场增长率为-10.66%。从以下图表我们可以发现,近年来脑苷肌肽的市场增长率一直在下降,从2017年开始出现负增长。
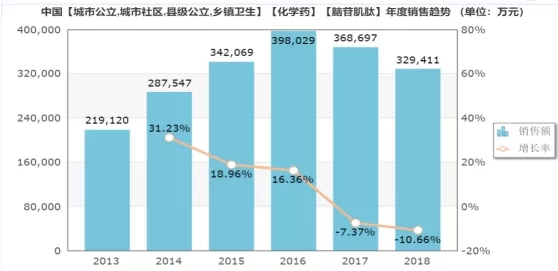
(数据来源:米内网)
而复方骨肽也有着相似的情况。根据米内网数据,复方骨肽2018年的市场销售额为8.2亿,市场增长率为-13.64%,其市场同样也是从2017年开始出现负增长的情况。
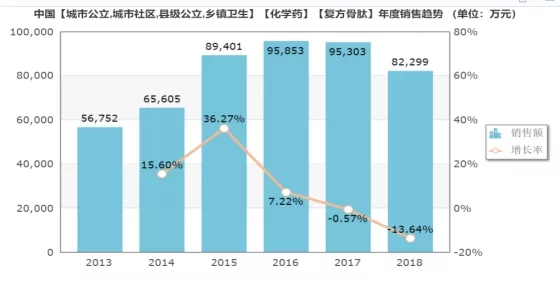
(数据来源:米内网)
看起来这些数据和国家重点监控目录公布、医保目录调整的时间节点似乎没什么关系,其实不然。 在国家公布重点监控目录之前,其实各地已经在做重点监控的工作,市场影响早已开始了。从米内网数据显示的各品种近年来的市场走势情况看,在国家卫健委发布的重点监控目录中,绝大部分品种从2015年开始,每年的市场增长率甚至是销售额都是下滑的。 我们也能看到,重点监控目录、调整医保目录、修订药品说明书,药品临床综合评价等一些列措施,都是为了不断优化医疗机构用药结构,提高安全用药、合理用药水平。
附:药品说明书修订要求
脑苷肌肽注射液说明书修订要求
一、增加【警示语】,内容如下
本品含有单唾液酸四己糖神经节苷脂。国内外药品上市后监测中发现可能与使用神经节苷脂产品相关的急性炎症性脱髓鞘性多发性神经病(又称吉兰-巴雷综合征)病例。若患者在用药期间(一般在用药后5—10天内)出现持物不能、四肢无力、弛缓性瘫痪等症状,应立即就诊。吉兰-巴雷综合征患者禁用本品。
二、【禁忌】修订为
以下患者禁用本品:
1.对本品及其任何成分过敏的患者;
2.遗传性糖脂代谢异常(神经节苷脂累积病,如:家族性黑蒙性痴呆、视网膜变性病)患者;
3.急性炎症性脱髓鞘性多发性神经病(又称吉兰—巴雷综合征)患者。
三、【注意事项】第4条修订为 国内外药品上市后监测中发现可能与使用神经节苷脂产品相关的吉兰-巴雷综合征病例。若患者在用药期间(一般在用药后5—10天内)出现持物不能、四肢无力、弛缓性瘫痪等症状,应立即就诊。吉兰-巴雷综合征患者禁用本品,自身免疫性疾病患者慎用本品。(注:说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)
复方骨肽注射剂说明书修订要求
一、在原有说明书基础上增加【警示语】:
本品有严重过敏反应病例报告,对本品过敏者禁用。本品应在有抢救条件的医疗机构使用,使用者应接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治。
二、【不良反应】必须包含但不限于以下内容:
上市后不良反应监测数据显示本品可见以下不良反应:
皮肤及其附件损害:皮疹、瘙痒、多汗、潮红、皮炎等。
全身性损害:胸闷、寒战、畏寒、发热、高热、胸痛、乏力、苍白、不适、颤抖、眼睑水肿等;有因过敏性休克导致死亡的个案报道。
消化系统损害:恶心、呕吐、腹胀、腹痛、腹泻、口干、胃肠道反应、肝功能异常等。
呼吸系统损害:呼吸困难、气促、咳嗽、憋气、咽喉异物感、喉头水肿、哮喘等。
免疫功能损害:过敏反应、过敏样反应、过敏性休克、面部水肿等。
心血管系统损害:心悸、紫绀、血压升高、血压降低、心前区不适等。
神经系统损害:头晕、头痛、局部或全身麻木、抽搐、意识模糊等。
血管损害和出凝血障碍:静脉炎。
有溶血性贫血急性发作、便血的个案报道。其他:注射部位疼痛、局部红肿、肌痛、关节痛、视觉异常、精神障碍、白细胞减少、白细胞升高等。
有肾功能异常、心肌酶谱改变的个案报道。
三、在原有【禁忌】的基础上,添加如下内容:
儿童禁用。孕妇及哺乳期妇女禁用。严重肝肾功能不全者禁用。
四、在原有【注意事项】的基础上,添加如下内容:
用药期间注意监测肝肾功能。
老年人使用无可靠参考资料,医务人员需权衡利弊,酌情使用。
建议使用0.9%氯化钠注射液作为溶媒。
临床使用应单独给药,需合并使用其他药物时,应分别滴注,且两组给药之间需冲管。
高钙血症者慎用。
高血压患者用药期间严密监测血压变化。
五、【儿童用药】修改为:未进行该项试验,且无可靠参考文献,儿童禁用。
六、【老年用药】修改为:未进行该项试验,且无可靠参考文献。
七、【孕妇及哺乳期妇女用药】修改为:
孕妇及哺乳期妇女禁用。
(注:说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)
关键词:脑苷肌肽注射液 复方骨肽注射剂
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1